Bioelementos y biomoléculas
Los bioelementos son los elementos químicos que se encuentran en la materia viva. Su número asciende a unos setenta y su clasificación es la que sigue:
- Bioelementos primarios, constituyen el 96% de la materia orgánica. indispensables para la formación de las biomoléculas orgánicas: oxígeno, carbono, hidrógeno, nitrógeno, fósforo y azufre.
- Bioelementos secundarios, constituyen el 3,9% de la materia orgánica. Pueden ser imprescindibles para la vida de algunos organismos, pero no para la de otros: sodio, potasio, cloro, calcio y magnesio.
- Oligoelementos,constituyen el 0,1% de la materia del total de átomos de los seres vivos y aparecen en cantidades pequeñísimas ‹ 0,1 % pero tiene una enorme importancia en el funcionamiento de multitud de reacciones bioquímicas: hierro, yodo, cobre, zinc, cromo, manganeso, fluor, vanadio, aluminio, molibdeno, selenio.
Las biomoléculas son los principios inmediatos o sustancias que componen la materia viva.
- Biomoléculas inorgánicas, como el agua y las sales minerales.
- Biomoléculas orgánicas, formadas por átomos de carbono y de hidrógeno (glúcidos, lípidos, proteínas y ácidos nucléicos), intervienen en la constitución de todos los seres vivos y sólo son producidas por ellos.
5.- ¿cuál es la diferencia entre un bioelemento primario y uno secundario?
6.- ¿Qué es un oligoelemento?
Biomoléculas inorgánicas
1.- El agua
Es la sustancia química más abundante de la materia viva y, por tanto, todas las reacciones químicas que experimentan los seres vivos se realizan en medio acuoso.
Su carácter de dipolo permite establecer enlaces de hidrógeno formando grupos de moléculas, alcanzando pesos moleculares elevados y comportándose como un líquido.
Características fundamentales del agua:
- Elevada fuerza de cohesión entre sus moléculas debido a los puentes de hidrógeno, lo que explica que sea un líquido incompresible, que tenga una alta tensión superficial y que se produzca el fenómeno de capilaridad.
- Elevado calor específico: hace falta mucho calor para elevar su temperatura, convirtiéndola en un estabilizador térmico del organismo.
- Elevado calor de vaporización: es necesario romper todos lo enlaces de hidrógeno para pasar de líquido a gas.
- Mayor densidad en estado líquido que en estado sólido: al flotar el hielo en el agua se forma una capa superficial termoaislante que permite la vida bajo ella.
Funciones del agua en los seres vivos
Función disolvente de las sustancias: las reacciones biológicas tienen lugar en medio acuoso.
Función bioquímica: interviene en la hidrólisis, como fuente de hidrógeno en la fotosíntesis, etcétera.
Función de transporte: transporta sustancias desde el exterior al interior del organismo y en la célula.
Función estructural: el agua da volumen y forma a las células.
Función mecánica amortiguadora: bolsas de líquido en las articulaciones.
Función termorreguladora: debido a su elevado calor específico y calor de vaporización.
7.- ¿Qué significa que las moléculas de agua están polarizadas?
8.- ¿Por qué es tan importante el agua para los seres vivos? 2.-Sales minerales
Las sustancias minerales se pueden encontrar en los seres vivos de tres formas:
- Precipitadas: constituyen estructuras sólidas, insolubles, con función esquelética.
- Disueltas: los cristales en disolución se disocian en aniones y cationes. Estos iones mantienen el grado de salinidad constante dentro del organismo y ayudan a mantener su pH.
- Asociadas a moléculas orgánicas: un ejemplo son las fosfoproteínas o los fosfolípidos.
Funciones de las sustancias minerales en los organismos
· Formar estructuras esqueléticas.
· Estabilizar dispersiones coloidales.
· Mantener el grado de salinidad en el medio interno.
· Constituir soluciones amortiguadoras o tampón.
· Realizar acciones específicas, siendo su presencia necesaria para la actividad de ciertas proteínas, como el Fe2+ en la hemoglobina, etcétera.
Las disoluciones
En los seres vivos, el estado líquido está compuesto por muchos tipos de moléculas o solutos dispersos en una única fase disolvente, que es el agua.
Los solutos se denominan cristaloides cuando son de bajo peso molecular y forman disoluciones verdaderas. Cuando el peso molecular de los solutos es elevado, se denominan coloides y forman dispersiones coloidales.
Propiedades de las disoluciones verdaderas.
- Difusión: es la repartición homogénea de las partículas de un fluido en el seno de otro cuando se ponen en contacto, debido al constante movimiento de las partículas.
- Ósmosis: es el paso del disolvente entre dos soluciones de diferente concentración a través de una membrana semipermeable, como lo es la membrana plasmática. El disolvente se mueve desde la disolución más diluida a la más concentrada.
- Estabilidad del grado de acidez o pH: valora cuantitativamente el grado de acidez y se define como pH= -log[H3O+]. Los valores de pH oscilan entre 0 y 14, siendo el pH = 7 el valor medio (pH >7, solución básica; pH<7, solución ácida).
Las disoluciones tampón o amortiguadoras permiten mantener constante el pH de los seres vivos, lo que resulta de enorme importancia para la vida. Las sales minerales disueltas en los líquidos biológicos pueden ionizarse, dando lugar a H3O+ o a OH- que contrarrestan el efecto de ácidos o bases añadidos.
Propiedades de las dispersiones coloidales:
- Capacidad de presentarse en estado de gel: las dispersiones coloidales pueden presentarse en forma de sol (estado líquido) o de gel (estado semisólido).
- Elevada viscosidad: resistencia interna que presenta un líquido al movimiento relativo de sus moléculas.
- Elevado poder adsorbente: atracción que ejerce la superficie de un sólido sobre las moléculas de un líquido o un gas.
- Efecto Tyndall: se observa cierta turbidez al iluminar lateralmente las dispersiones coloidales sobre un fondo oscuro.
- Sedimentación: si se someten a fuertes campos gravitatorios se sedimentan sus partículas.
- Diálisis: separación de coloides de los cristaloides gracias a una membrana semipermeable que sólo permite pasar a las moléculas pequeñas.
- Electroforesis: transporte de partículas coloidales a través de un gel debido a la acción de un campo eléctrico.
¿Por qué el carbono y no el silicio?
Aunque el silicio (Si) presenta también cuatro electrones en su última capa y es mucho más abundante en la corteza terrestre que el carbono (C), la vida está basada en el C y no en el Si, porque los enlaces C-C, C=O y C-N son fuertes para formar cadenas y anillos estables, a la vez que pueden romperse para dar lugar a otras moléculas, permitiendo al ser vivo obtener la energía contenida en sus enlaces. En cambio, las cadenas Si-Si son inestables y las Si-O-Si-O- son tan estables que resultan inalterables.
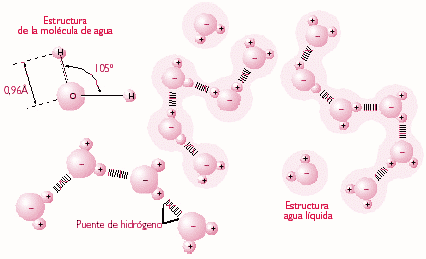


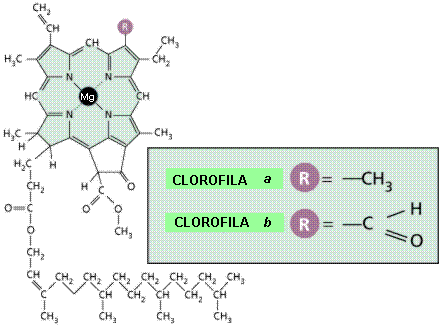 Molécula de clorofila
Molécula de clorofila
Biomoléculas inorgánicas: el agua y las sales minerales
1.- El agua
El agua es una biomolécula inorgánica. Se trata de la biomolécula más abundante en los seres vivos. En las medusas, puede alcanzar el 98% del volumen del animal y en la lechuga, el 97% del volumen de la planta. Estructuras como el líquido interno de animales o plantas, embriones o tejidos conjuntivos suelen contener gran cantidad de agua. Otras estructuras, como semillas, huesos, pelo, escamas o dientes poseen poca cantidad de agua en su composición.
1.1.- Estructura del agua
El agua es una molécula formada por dos átomos de Hidrógeno y uno de Oxígeno. La unión de esos elementos con diferente electronegatividad proporciona unas características poco frecuentes. Estas características son:
- La molécula de agua forma un ángulo de 104,5º.
- La molécula de agua es neutra.
- La molécula de agua, aun siendo neutra, forma un dipolo, aparece una zona con un diferencial de carga positivo en la región de los Hidrógenos, y una zona con diferencial de carga negativo, en la región del Oxígeno.
- El dipolo facilita la unión entre moléculas, formando puentes de hidrógeno, que unen la parte electropositiva de una molécula con la electronegativa de otra.
1.2.- Propiedades del agua
El agua tiene propiedades especiales, derivadas de su singular estructura. Estas propiedades son:
- Alto calor específico: para aumentar la temperatura del agua un grado centígrado es necesario comunicarle mucha energía para poder romper los puentes de Hidrógeno que se generan entre las moléculas.
- Alto calor de vaporización: el agua absorbe mucha energía cuando pasa de estado líquido a gaseoso.
- Alta tensión superficial: las moléculas de agua están muy cohesionadas por acción de los puentes de Hidrógeno. Esto produce una película de agua en la zona de contacto del agua con el aire. Como las moléculas de agua están tan juntas el agua es incompresible.
- Capilaridad: el agua tiene capacidad de ascender por las paredes de un capilar debido a la elevada cohesión molecular.
- Alta constante dieléctrica: la mayor parte de las moléculas de agua forman un dipolo, con un diferencial de carga negativo y un diferencial de carga positivo.
- Bajo grado de ionización: la mayor parte de las moléculas de agua no están disociadas. Sólo un reducido número de moléculas sufre disociación, generando iones positivos (H+) e iones negativos (OH-). En el agua pura, a 25ºC, sólo una molécula de cada 10.000.000 está disociada, por lo que la concentración de H+ es de 10-7. Por esto, el pH del agua pura es igual a 7.
- La densidad del agua: en estado líquido, el agua es más densa que en estado sólido. Por ello, el hielo flota en el agua. Esto es debido a que los puentes de Hidrógeno formados a temperaturas bajo cero unen a las moléculas de agua ocupando mayor volumen.
1.3.- Importancia biológica del agua
Las propiedades del agua permiten aprovechar esta molécula para algunas funciones para los seres vivos. Estas funciones son las siguientes:
- Disolvente polar universal: el agua, debido a su elevada constante dieléctrica, es el mejor disolvente para todas aquellas moléculas polares. Sin embargo, moléculas apolares no se disuelven en el agua.
- Lugar donde se realizan reacciones químicas: debido a ser un buen disolvente, por su elevada constante dieléctrica, y debido a su bajo grado de ionización.
- Función estructural: por su elevada cohesión molecular, el agua confiere estructura, volumen y resistencia.
- Función de transporte: por ser un buen disolvente, debido a su elevada constante dieléctrica, y por poder ascender por las paredes de un capilar, gracias a la elevada cohesión entre sus moléculas, los seres vivos utilizan el agua como medio de transporte por su interior.
- Función amortiguadora: debido a su elevada cohesión molecular, el agua sirve como lubricante entre estructuras que friccionan y evita el rozamiento.
- Función termorreguladora: al tener un alto calor específico y un alto calor de vaporización el agua es un material idóneo para mantener constante la temperatura, absorbiendo el exceso de calor o cediendo energía si es necesario.
- Función termoaislante: al flotar el hielo en el agua se forma un capa superficial termoaislante que permite la vida bajo ella.
2.- Las sales minerales
Las sales minerales son biomoléculas inorgánicas que aparecen en los seres vivos de forma precipitada, disuelta en forma de iones o asociada a otras moléculas.
2.1.- Precipitadas
Las sales se forman por unión de un ácido con una base, liberando agua. En forma precipitada forman estructuras duras, que proporcionan estructura o protección al ser que las posee. Ejemplos son las conchas, los caparazones o los esqueletos.
2.2.-Disueltas
Las sales disueltas en agua manifiestan cargas positivas o negativas. Los cationes más abundantes en la composición de los seres vivos son Na+, K+, Ca2+, Mg2+... Los aniones más representativos en la composición de los seres vivos son Cl-, PO43-, CO32-... Las sales disueltas en agua pueden realizar funciones tales como:
- Mantener el grado de grado de salinidad.
- Amortiguar cambios de pH, mediante el efecto tampón.
- Controlar la contracción muscular
- Producir gradientes electroquímicos
- Estabilizar dispersiones coloidales.
2.3.- Asociadas a otras moléculas
Los iones pueden asociarse a moléculas, permitiendo realizar funciones que, por sí solos no podrían, y que tampoco realizaría la molécula a la que se asocia, si no tuviera el ión. La hemoglobina es capaz de transportar oxígeno por la sangre porque está unida a un ión Fe++. Los citocromos actúan como transportadores de electrones porque poseen un ión Fe+++. La clorofila captura energía luminosa en el proceso de fotosíntesis por contener un ión Mg++ en su estructura.
7.- ¿Qué significa que las moléculas de agua estan polarizadas?
8.- ¿Por qué es tan importante el agua para los seres vivos?
Biomoléculas orgánicas
Nombre
|
Función
| |